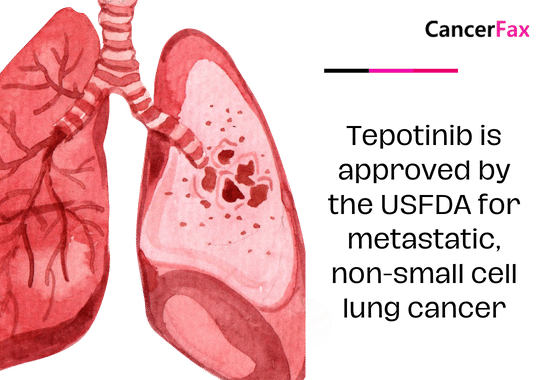
ອົງການອາຫານ ແລະຢາໄດ້ອະນຸມັດ tepotinib (Tepmetko, EMD Serono, Inc.) ຢ່າງເປັນທາງການໃນວັນທີ 15 ກຸມພາ 2024, ສໍາລັບຄົນເຈັບຜູ້ໃຫຍ່ທີ່ເປັນມະເຮັງປອດຂອງຈຸລັງຂະໜາດນ້ອຍ (NSCLC) ທີ່ມີ mesenchymal-epithelial transition (MET) exon 14 skipping mutations .
Tepotinib ໄດ້ຮັບການເລັ່ງການເກັບກູ້ສໍາລັບການນໍາໃຊ້ນີ້ໃນວັນທີ 3 ເດືອນກຸມພາ 2021, ຫຼັງຈາກສະແດງໃຫ້ເຫັນຜົນໄດ້ຮັບໃນທາງບວກໃນການທົດລອງ VISION (NCT02864992), ເຊິ່ງເປັນການຄົ້ນຄວ້າ multicohort, ທີ່ບໍ່ແມ່ນແບບສຸ່ມ, ເປີດປ້າຍຊື່, multicohort. ການຫັນປ່ຽນໄປສູ່ການອະນຸມັດແບບດັ້ງເດີມແມ່ນໄດ້ເຮັດຫຼັງຈາກລວມເອົາຄົນເຈັບຕື່ມອີກ 161 ຄົນແລະຂະຫຍາຍໄລຍະເວລາການຕິດຕາມໂດຍ 28 ເດືອນເພື່ອປະເມີນໄລຍະເວລາຂອງການຕອບສະຫນອງ.
Effectiveness was proven in 313 individuals with metastatic ມະເລັງປອດທີ່ບໍ່ແມ່ນຈຸລັງນ້ອຍ (NSCLC) carrying MET exon skipping mutations. Patients were administered a daily dose of 450 mg of tepotinib until disease progression or unacceptable toxicity occurred.
ເງື່ອນໄຂປະສິດທິພາບຕົ້ນຕໍແມ່ນອັດຕາການຕອບສະຫນອງຈຸດປະສົງ (ORR) ແລະໄລຍະເວລາຂອງການຕອບສະຫນອງ (DOR), ປະເມີນໂດຍຄະນະກໍາມະການທົບທວນເອກະລາດຕາບອດ. ໃນບັນດາຄົນເຈັບ 164 ຄົນທີ່ບໍ່ມີການປິ່ນປົວກ່ອນ, ອັດຕາການຕອບສະຫນອງຈຸດປະສົງ (ORR) ແມ່ນ 57% ກັບ 95% ໄລຍະເວລາຄວາມຫມັ້ນໃຈ (CI) ຂອງ 49 ຫາ 65. ໃນບັນດາຜູ້ຕອບສະຫນອງ, 40% ມີໄລຍະເວລາຕອບສະຫນອງ (DOR) ຂອງ. 12 ເດືອນ ຫຼືຫຼາຍກວ່ານັ້ນ. ໃນບັນດາຄົນເຈັບ 149 ຄົນທີ່ໄດ້ຮັບການປິ່ນປົວກ່ອນ, ອັດຕາການຕອບສະຫນອງຈຸດປະສົງ (ORR) ແມ່ນ 45% ທີ່ມີ 95% ໄລຍະເວລາຄວາມຫມັ້ນໃຈ (CI) ຂອງ 37 ຫາ 53. ນອກຈາກນັ້ນ, 36% ຂອງຜູ້ຕອບສະຫນອງມີໄລຍະເວລາຂອງການຕອບສະຫນອງ (DOR) ຂອງ. 12 ເດືອນ ຫຼືຫຼາຍກວ່ານັ້ນ.
ຜົນກະທົບທາງລົບທີ່ເດັ່ນຊັດ (≥20%) ປະກອບມີອາການບວມ, ປວດຮາກ, ອ່ອນເພຍ, ປວດກ້າມເນື້ອ, ຖອກທ້ອງ, ຫາຍໃຈຍາກ, ຫຼຸດລົງຄວາມຢາກອາຫານ, ແລະຕຸ່ມຜື່ນ.
ປະລິມານທີ່ແນະນໍາຂອງ tepotinib ແມ່ນ 450 ມລກ ກິນມື້ລະເທື່ອພ້ອມອາຫານ.

Myeloma
NMPA ອະນຸມັດ zevorcabtagene autoleucel CAR T Cell therapy ສໍາລັບ R/R multiple myeloma
ການປິ່ນປົວດ້ວຍ Zevor-Cel ຜູ້ຄວບຄຸມຈີນໄດ້ອະນຸມັດ zevorcabtagene autoleucel (zevor-cel; CT053), ການປິ່ນປົວດ້ວຍ CAR T-cell autologous, ສໍາລັບການປິ່ນປົວຄົນເຈັບຜູ້ໃຫຍ່ທີ່ມີໂຣກ myeloma ຫຼາຍໆຊະນິດ.